手把手带你认识锂离子电池
一、前言
本文引用地址:http://www.amcfsurvey.com/article/201710/369039.htm这里所说的锂离子电池特指可反复充电的二次锂离子电池,而不是用完就扔的一次电池。
锂离子电池分布在我们生活的每一个角落,其应用领域包括手机、平板电脑、笔记本电脑、智能手表、移动电源(充电宝)、应急电源、剃须刀、电动自行车、电动汽车、电动公交车、旅游观光车、无人机,以及其他各类电动工具。作为电能的载体和众多设备的动力来源,可以说,离开了锂离子电池,当今的物质世界就玩不转了(除非我们想倒退回几十年前)。那么,锂离子电池到底是什么鬼?
本文不科普电池的基本原理和发展历史,有兴趣的请百度查询,这里头有很多故事。物理学和化学领域的基础理论,被爱因斯坦之前的那一波人基本上搞得七七八八了,电池跟这两个领域直接相关,与电池有关的理论,在二战之前就已经研究的差不多了,二战以后并无大的创新。作为电池技术的一种,锂离子电池的相关理论研究,近年来也没有什么突破性进展,大多数研究都集中在材料、配方、工艺等方面,也就是如何提高产业化的程度,研究出性能更优异的锂离子电池(存储能量更多,用的更久)。
很多人在使用锂离子电池,很多人在研究锂离子电池的产品应用(如上面提到的产品),可是大多数人对锂离子电池知之甚少,或者总是雾里看花,不得要领。写本文的目的,不是为了给做锂离子电池研发的人看的,而是给那些在产品里面用到锂离子电池的工程技术人员或者锂离子电池的使用者看的。所以本文力求通俗易懂,尽量不使用专业化的术语和公式,希望在轻松阅读之余,能够提升大家对锂离子电池的认识,起到答疑解惑的作用。
作者本人不是锂离子电池领域的专家,没有从事过锂离子电池单体的技术或产品研发,但曾长期从事锂离子电池的应用技术研究,因此希望站在“用户”的角度,来阐述我对锂离子电池的认识。普通用户,通常把锂离子电池直接叫作锂电池,虽然两者并不完全等同,但锂离子电池确实是当前锂电池的绝对主体。
文中大部分的内容,都不是本人的原创,而是已经存在的知识,站在巨人的肩膀上,我们要做的仅仅是站直身体,抬起头,世界就在我们眼前。
二、锂离子电池的基本原理
1.如何选择能量的载体
首先大家会问,为什么选择锂元素作为能量载体?
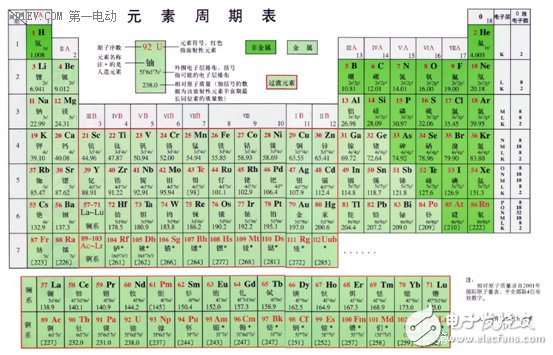
好吧,虽然我们不想去回顾化学的知识,可是这个问题必须得去元素周期表找答案,好在,大家总还记得元素周期表吧?!实在不记得,我们就花一分钟来看看下面的表吧。
要想成为好的能量载体,就要以尽可能小的体积和重量,存储和搬运更多的能量。因此,需要满足下面几个基本条件:
1)原子相对质量要小
2)得失电子能力要强
3)电子转移比例要高
基于这3项基本原则,元素周期表上面的元素比下面的元素要好,左边的元素比右边的元素要好。初步筛选,我们只能在元素周期表的第一周期和第二周期里面去找材料:氢、氦、锂、铍、硼、碳、氮、氧、氟、氖。排除惰性气体和氧化剂,只剩下氢、锂、铍、硼、碳,这5个元素。
氢元素是自然界最好的能量载体,所以氢燃料电池的研究一直方兴未艾,代表了电池领域一个非常有前途的方向。当然,如果核裂变技术在未来几十年能够取得重大突破,可以做到小型化甚至微型化,那么便携式的核燃料电池将会有广阔的发展空间。
接下来就是锂了,选择锂元素来做电池,是基于地球当前的所有元素中,我们能够找到的相对优解(铍的储量太少了,是稀有金属中的稀有金属)。氢燃料电池与锂离子电池的技术路线之争,在电动汽车领域打的如火如荼,大概就是因为这两种元素,是我们目前能够找到的比较好的能量载体。当然,这里面还牵涉到很多的商业利益,甚至政治博弈,这些不是本文要讨论的范畴。
顺便说一下,自然界中已经存在的,并为人类广泛使用的能源,比如石油、天然气、煤炭等,其主要成分也是碳、氢、氧等元素(在元素周期表的第一周期和第二周期)。所以不管是自然的选择,还是人类的“设计”,最终都是殊途同归的。
2.锂离子电池的工作原理
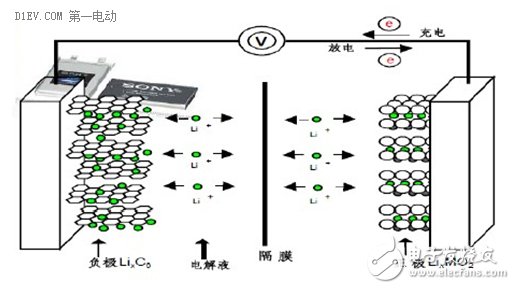
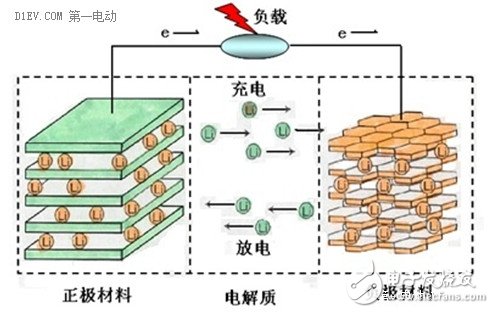
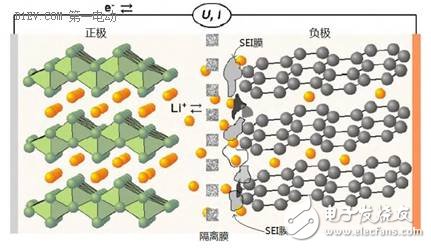
下面讲讲锂离子电池的工作机理。这里不阐述氧化还原反应,化学基础不好的,或者已经把化学知识还给老师的人,看到这些专业的东西就会头晕,所以我们还是搞点直白的描述。这里借用一张图,这张图比较容易让人理解锂离子电池的原理。
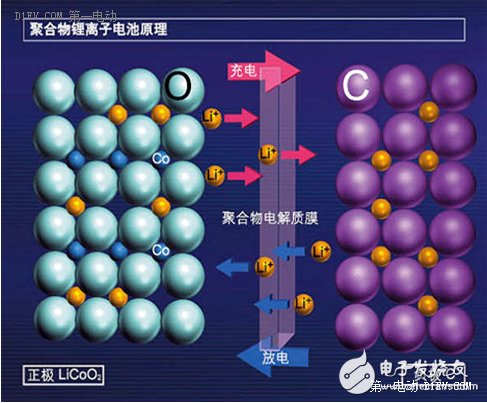
我们按照使用的习惯,根据充放电时的电压差区分正极(+)和负极(-),这里不讲阳极和阴极,费时费力。这张图上,电池的正极材料是钴酸锂(LiCoO2),负极材料是石墨(C)。
充电的时候,在外加电场的影响下,正极材料LiCoO2分子里面的锂元素脱离出来,变成带正电荷的锂离子(Li+),在电场力的作用下,从正极移动到负极,与负极的碳原子发生化学反应,生成LiC6,于是从正极跑出来的锂离子就很“稳定”的嵌入到负极的石墨层状结构当中。从正极跑出来转移到负极的锂离子越多,这个电池可以存储的能量就越多。
放电的时候刚好相反,内部电场转向,锂离子(Li+)从负极脱离出来,顺着电场的方向,又跑回到正极,重新变成钴酸锂分子(LiCoO2)。从负极跑出来转移到正极的锂离子越多,这个电池可以释放的能量就越多。
在每一次充放电循环过程中,锂离子(Li+)充当了电能的搬运载体,周而复始的从正极→负极→正极来回的移动,与正、负极材料发生化学反应,将化学能和电能相互转换,实现了电荷的转移,这就是“锂离子电池”的基本原理。由于电解质、隔离膜等都是电子的绝缘体,所以这个循环过程中,并没有电子在正负极之间的来回移动,它们只参与电极的化学反应。
3.锂离子电池的基本构成
要实现上述的功能,锂离子电池内部需要包含几种基本材料:正极活性物质、负极活性物质、隔离膜、电解质。下面做简单论述,这些材料都是干嘛的。
正负极不难理解,要实现电荷移动,就需要存在电位差的正负极材料,那么什么是活性物质?我们知道,电池实际上是将电能和化学能相互转换,以实现能量的存储和释放。要实现这个过程,就需要正负极的材料很“容易”参与化学反应,要活泼,要容易氧化和还原,从而实现能量转换,所以我们需要“活性物质”来做电池的正负极。
上面已经提到,锂元素是我们做电池的优选材料,那么为什么不用金属锂来做电极的活性物质呢?这样不是可以达到最大的能量密度吗?
我们再看上面这张图,氧(O)、钴(Co)、锂(Li)三种元素构成了非常稳定的正极材料结构(图中的比例和排列仅作参考),负极石墨的碳原子排列也具有非常稳定的层状结构。正负极材料不但要活泼,还要具有非常稳定的结构,才能实现有序的,可控的化学反应。不稳定的结果是什么?想想汽油燃烧和炸弹爆炸,能量剧烈释放,这个化学反应的过程实际上是无法人为去精确控制的,于是化学能变成了热能,一次性把能量释放完毕,而且不可逆。
金属形态存在的锂元素太“活泼”了,调皮的孩子多半都不听话,喜欢搞破坏。早期针对锂电池的研究,确实是集中以金属锂或其合金作为负极这个方向,但是因为安全问题突出,不得不寻找其他更好的路径。近年来,随着人们对能量密度的追求,这个研究方向又有“满血复活”的趋势,这个我们后面会讲到。
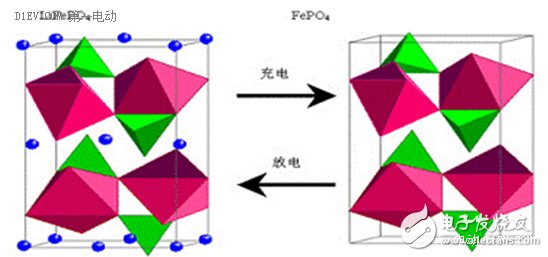
为了实现能量存储和释放过程中的化学稳定性,即电池充放电循环的安全性和长寿命,我们需要一种电极材料,在需要活泼的时候活泼,在需要稳定的时候稳定。经过长期的研究和探索,人们找到了几种锂的金属氧化物,如钴酸锂、钛酸锂、磷酸铁锂、锰酸锂、镍钴锰三元等材料,作为电池正极或负极的活性物质,解决了上述问题。如上图所示,磷酸铁锂的橄榄石结构也是一种非常稳定的正极材料结构,充放电过程中锂离子的脱嵌,并不会造成晶格坍塌。题外话,锂金属电池确实是有的,但与锂离子电池相比,几乎可以忽略不计,技术的发展,最终还是要服务于市场。
当然,在解决了稳定性问题的同时,也带来了严重的“副作用”,就是作为能量载体的锂元素占比大大降低,能量密度降了不止一个数量级,有得必有失,自然之道啊。
负极通常选择石墨或其他碳材料做活性物质,也是遵循上述的原则,既要求是好的能量载体,又要相对稳定,还要有相对丰富的储量,便于大规模制造,找来找去,碳元素就是一个相对优解。当然,这并不是唯一解,针对负极材料的研究很广泛,后面有论述。
电解质是干嘛的?通俗的讲,就是游泳池里面的“水”,让锂离子能够自由的游来游去,所以呢,离子电导率要高(游泳的阻力小),电子电导率要小(绝缘),化学稳定性要好(稳定压倒一切啊),热稳定性要好(都是为了安全),电位窗口要宽。基于这些原则,经过长期的工程探索,人们找到了由高纯度的有机溶剂、电解质锂盐、和必要的添加剂等原料,在一定条件下、按一定比例配制而成的电解质。有机溶剂有PC(碳酸丙烯酯),EC(碳酸乙烯酯),DMC(碳酸二甲酯),DEC(碳酸二乙酯),EMC(碳酸甲乙酯)等材料。电解质锂盐有LiPF6,LiBF4等材料。
隔离膜则是为了阻止正负极材料直接接触而加进来的,我们希望把电池做的尽可能的小,存储的能量尽可能的多,于是正负极之间的距离越来越小,短路成为一个巨大的风险。为了防止正负极材料短路,造成能量的剧烈释放,就需要用一种材料将正负极“隔离”开来,这就是隔离膜的由来。隔离膜需要具有良好的离子通过性,主要是给锂离子开放通道,让其可以自由通过,同时又是电子的绝缘体,以实现正负极之间的绝缘。目前市场上的隔膜主要有单层PP,单层PE,双层PP/PE,三层PP/PE/PP复合膜等。
4.锂离子电池的完整材料构成
除了上面提到的4种主要材料之外,要想把锂离子电池从实验室的一个“实验品”变成一个可以商业化应用的产品,还需要其他一些不可或缺的材料。

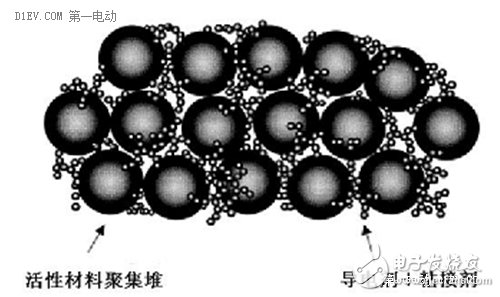
我们先看电池的正极,除了活性物质之外,还有导电剂和粘结剂,以及用作电流载体的基体和集流体(正极通常是铝箔)。粘结剂要把作为活性物质的锂金属氧化物均匀的“固定”在正极基带上面,导电剂则要增强活性物质与基体的电导率,以达到更大的充放电电流,集流体负责充当电池内外部的电荷转移桥梁。

负极的构造与正极基本相同,需要粘结剂来固定活性物质石墨,需要铜箔作为基体和集流体来充当电流的导体,但因为石墨本身良好的导电性,所以负极一般不添加导电剂材料。
除了以上材料外,一个完整的锂离子电池还包括绝缘片、盖板、泄压阀、壳体(铝,钢,复合膜等),以及其他一些辅助材料。
5.锂离子电池的制作工艺
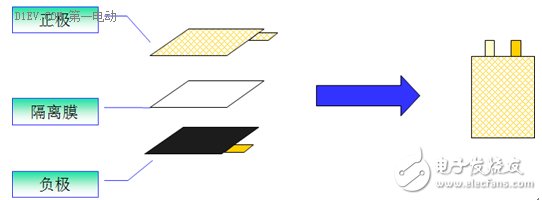
锂离子电池的制作工艺比较复杂,此处仅就部分关键工序做简单描述。根据极片装配方式的不同,通常有卷绕和叠片两种工艺路线。
叠片工艺是将正极、负极切成小片与隔离膜叠合成小电芯单体,然后将小电芯单体叠放并联起来,组成一个大电芯的制造工艺,其大体工艺流程如下:
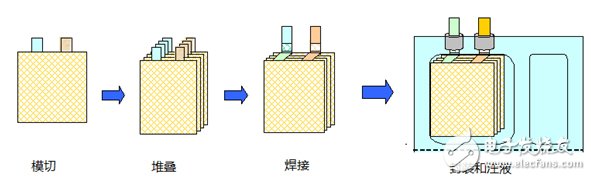
卷绕工艺是将正负极片、隔离膜、正负极耳、保护胶带、终止胶带等物料固定在设备上,设备经过放卷完成电芯制作。
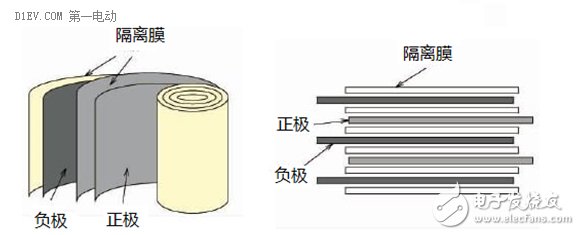
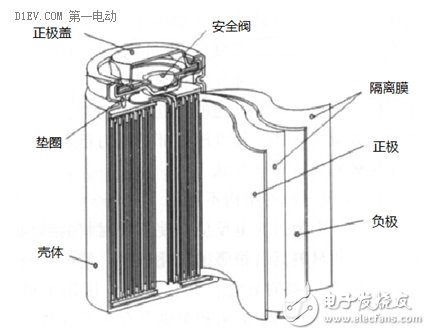
锂离子电池的常见外形主要有圆柱形和方形,根据壳体材料不同,又有金属外壳和软包外壳等。

锂离子电池的主要参数指标#e#
三、 主要参数指标
锂离子电池具有能量密度高、转换效率高、循环寿命长、无记忆效应、无充放电延时、自放电率低、工作温度范围宽和环境友好等优点,因而成为电能的一个比较理想的载体,在各个领域得到广泛的应用。
一般而言,我们在使用锂离子电池的时候,会关注一些技术指标,作为衡量其性能“优劣”的主要因素。那么,哪些指标是我们需要在使用的时候,应该予以特别关注呢?
1. 容量
这是大家比较关心的一个参数。智能手机早已普及,我们在使用智能手机的时候,最为担心的就是电量不足,需要频繁充电,有时还找不到地方充电。早期的功能机,正常使用情况下,满充的电池可以待机3~5天,一些产品甚至可以待机7天以上。可是到了智能机时代,待机时间就显得惨不忍睹了。这里面很重要的一个原因,就是手机的功耗越来越大,而电池的容量却没有同比例的增长。

容量的单位一般为“mAh”(毫安时)或“Ah”(安时),在使用时又有额定容量和实际容量的区别。额定容量是指满充的锂离子电池在实验室条件下(比较理想的温湿度环境),以某一特定的放电倍率(C-rate)放电到截止电压时,所能够提供的总的电量。实际容量一般都不等于额定容量,它与温度、湿度、充放电倍率等直接相关。一般情况下,实际容量比额定容量偏小一些,有时甚至比额定容量小很多,比如北方的冬季,如果在室外使用手机,电池容量会迅速下降。
2. 能量密度
能量密度,指的是单位体积或单位重量的电池,能够存储和释放的电量,其单位有两种:Wh/kg,Wh/L,分别代表重量比能量和体积比能量。这里的电量,是上面提到的容量(Ah)与工作电压(V)的积分。在应用的时候,能量密度这个指标比容量更具有指导性意义。
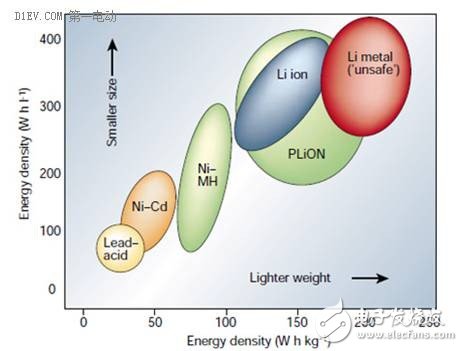
基于当前的锂离子电池技术,能够达到的能量密度水平大约在100~200Wh/kg,这一数值还是比较低的,在许多场合都成为锂离子电池应用的瓶颈。这一问题同样出现在电动汽车领域,在体积和重量都受到严格限制的情况下,电池的能量密度决定了电动汽车的单次最大行驶里程,于是出现了“里程焦虑症”这一特有的名词。如果要使得电动汽车的单次行驶里程达到500公里(与传统燃油车相当),电池单体的能量密度必须达到300Wh/kg以上。
锂离子电池能量密度的提升,是一个缓慢的过程,远低于集成电路产业的摩尔定律,这就造成了电子产品的性能提升与电池的能量密度提升之间存在一个剪刀差,并且随着时间不断扩大。
3. 充放电倍率
这个指标会影响锂离子电池工作时的连续电流和峰值电流,其单位一般为 C(C-rate的简写),如1/10C,1/5C,1C,5C,10C等。举个例子来阐述倍率指标的具体含义,某电池的额定容量是10Ah,如果其额定充放电倍率是1C,那么就意味着这个型号的电池,可以以10A的电流,进行反复的充放电,一直到充电或放电的截止电压。如果其最大放电倍率是 10C@10s,最大充电倍率5C@10s,那么该电池可以以100A的电流进行持续10秒的放电,以50A的电流进行持续10秒的充电。
充放电倍率对应的电流值乘以工作电压,就可以得出锂离子电池的连续功率和峰值功率指标。充放电倍率指标定义的越详细,对于使用时的指导意义越大。尤其是作为电动交通工具动力源的锂离子电池,需要规定不同温度条件下的连续和脉冲倍率指标,以确保锂离子电池使用在合理的范围之内。
4. 电压
锂离子电池的电压,有开路电压、工作电压、充电截止电压、放电截止电压等一些参数,本文不再分开一一论述,而是集中做个解释。
开路电压,顾名思义,就是电池外部不接任何负载或电源,测量电池正负极之间的电位差,此即为电池的开路电压。
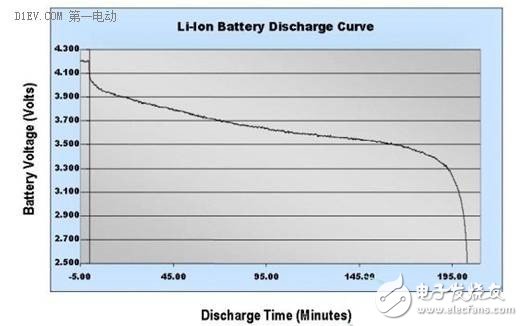
工作电压,就是电池外接负载或电源,处在工作状态,有电流流过时,测量所得的正负极之间的电位差。一般来说,由于电池内阻的存在,放电状态时的工作电压低于开路电压,充电时的工作电压高于开路电压。
充/放电截止电压,是指电池允许达到的最高和最低工作电压。超过了这一限值,会对电池产生一些不可逆的损害,导致电池性能的降低,严重时甚至造成起火、爆炸等安全事故。
电池的开路电压和工作电压,与电池的容量存在一定的对应关系。
5. 寿命
锂离子电池的寿命会随着使用和存储而逐步衰减,并且会有较为明显的表现。仍然以智能手机为例,使用过一段时间的手机,可以很明显的感觉到手机电池“不耐用”了,刚开始可能一天只充一次,后面可能需要一天充电两次,这就是电池寿命不断衰减的体现。
锂离子电池的寿命分为循环寿命和日历寿命两个参数。循环寿命一般以次数为单位,表征电池可以循环充放电的次数。当然这里也是有条件的,一般是在理想的温湿度下,以额定的充放电电流进行深度的充放电(100% DOD或者80%DOD),计算电池容量衰减到额定容量的80%时,所经历的循环次数。
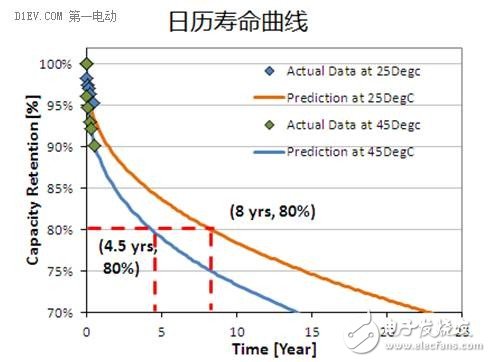
日历寿命的定义则比较复杂,电池不可能一直在充放电,有存储和搁置,也不可能一直处于理想环境条件,会经历各种温湿度条件,充放电的倍率也是时刻在变化的,所以实际的使用寿命就需要模拟和测试。简单的说,日历寿命就是电池在使用环境条件下,经过特定的使用工况,达到寿命终止条件(比如容量衰减到80%) 的时间跨度。日历寿命与具体的使用要求是紧密结合的,通常需要规定具体的使用工况,环境条件,存储间隔等。
日历寿命比循环寿命更具有实际意义,但由于日历寿命的测算非常复杂,而且耗时太长,所以一般电池厂家只给出循环寿命的数据。如需要获得日历寿命的数据,通常要额外付费,且要等待很长时间。
6. 内阻
锂离子电池的内阻是指电池在工作时,电流流过电池内部所受到的阻力,它包括欧姆内阻和极化内阻,极化内阻又包括电化学极化内阻和浓差极化内阻。
欧姆内阻由电极材料、电解质、隔膜电阻及各部分零件的接触电阻组成。极化内阻是指电化学反应时由极化引起的电阻,包括电化学极极化和浓差极化引起的电阻。
内阻的单位一般是毫欧姆(mΩ),内阻大的电池,在充放电的时候,内部功耗大,发热严重,会造成锂离子电池的加速老化和寿命衰减,同时也会限制大倍率的充放电应用。所以,内阻做的越小,锂离子电池的寿命和倍率性能就会越好。
7. 自放电
电池在放置的时候,其容量是在不断下降的,容量下降的速率称为自放电率,通常以百分数表示:%/月。
自放电是我们不希望看到的,一个充满电的电池,放个几个月,电量就会少很多,所以我们希望锂离子电池的自放电率越低越好。
这里需要特别注意,一旦锂离子电池的自放电导致电池过放,其造成的影响通常是不可逆的,即使再充电,电池的可用容量也会有很大损失,寿命会快速衰减。所以长期放置不用的锂离子电池,一定要记得定期充电,避免因为自放电导致过放,性能受到很大影响。
8. 工作温度范围
由于锂离子电池内部化学材料的特性,锂离子电池有一个合理的工作温度范围(常见的数据在-40℃~60℃之间),如果超出了合理的范围使用,会对锂离子电池的性能造成较大的影响。
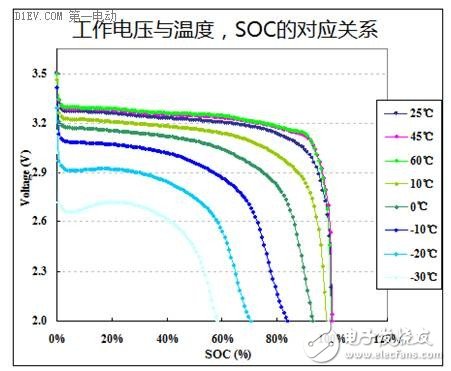
不同材料的锂离子电池,其工作温度范围也是不一样的,有些具有良好的高温性能,有些则能够适应低温条件。锂离子电池的工作电压、容量、充放电倍率等参数都会随着温度的变化而发生非常显著的变化。长时间的高温或低温使用,也会使得锂离子电池的寿命加速衰减。因此,努力创造一个适宜的工作温度范围,才能够最大限度的提升锂离子电池的性能。
除了工作温度有限制之外,锂离子电池的存储温度也是有严格约束的,长期高温或低温存储,都会对电池性能造成不可逆的影响。
四、 锂离子电池的正负极材料
我们经常会看到磷酸铁锂,三元等专业的锂离子电池术语,这些都是根据锂离子电池正极材料来区分锂离子电池的类型。相对来讲,锂离子电池的正、负极材料对电池性能的影响比较大,是大家比较关心的方面。那么,当前市场上都有哪些常见的正负极材料呢?用他们做锂离子电池,又有哪些优缺点?
1. 正极材料
首先,我们来看看正极材料,正极材料的选择,主要基于以下几个因素考虑:
1) 具有较高的氧化还原反应电位,使锂离子电池达到较高的输出电压;
2) 锂元素含量高,材料堆积密度高,使得锂离子电池具有较高的能量密度;
3) 化学反应过程中的结构稳定性要好,使得锂离子电池具有长循环寿命;
4) 电导率要高,使得锂离子电池具有良好的充放电倍率性能;
5) 化学稳定性和热稳定性要好,不易分解和发热,使得锂离子电池具有良好的安全性;
6) 价格便宜,使得锂离子电池的成本足够低;
7) 制造工艺相对简单,便于大规模生产;
8) 对环境的污染低,易于回收利用。
当前,锂离子电池的能量密度、充放电倍率、安全性等一些关键指标,主要受制于正极材料。
基于这些因素考虑,经过工程研究和市场化检验,目前市场常见的正极材料如下表所示:
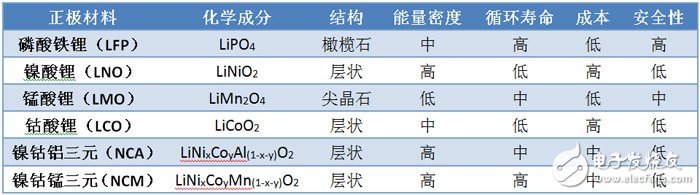
钴酸锂的商业化应用走的最早,第一代商业化应用的锂离子电池就是SONY在1990年推向市场的钴酸锂离子电池,随后在消费类产品中得到大规模应用。随着手机、笔记本、平板电脑的大规模普及,钴酸锂一度是锂离子电池正极材料中销售量占比最大的材料。但其固有的缺点是质量比容量(不等同于能量密度)低,理论极限是274mAh/g,出于正极结构稳定性考虑,实际只能达到理论值的50%,即137mAh/g。同时,由于地球上钴元素的储量比较低,也导致钴酸锂的成本偏高,难以在动力电池领域大规模普及,所以钴酸锂正极材料将被其他材料逐步取代。
由于稳定性,安全性,材料合成困难等方面的缺点,镍酸锂的商业应用较少,市场上很少看到,这里不做论述。
锰酸锂的商业化应用,主要在动力电池领域,是锂离子电池一个比较重要的分支。如日产的leaf纯电动轿车采用了日本AESC公司的锰酸锂离子电池,早期的雪弗兰Volt也采用韩国LG化学的锰酸锂离子电池。锰酸锂的突出优点是成本低,低温性能好,缺点是比容量低,极限在148mAh/g,且高温性能差,循环寿命低。所以锰酸锂的发展有明显的瓶颈,近年来的研究方向主要是改性锰酸锂,通过掺杂其他元素,改变其缺点。
磷酸铁锂材料在中国热过一阵子,一方面受美国科研机构和企业在技术方面的带动,另一方面受比亚迪在国内的产业化推动,前几年国内的锂离子电池企业在动力电池领域基本都以磷酸铁锂材料为主。但是随着全球各国对锂离子电池能量密度的要求越来越高,而磷酸铁锂的比容量理论极限是170mAh/g,而实际上只能达到120mAh/g左右,已经无法满足当前和未来的市场需求。此外,磷酸铁锂的倍率性能一般,低温特性差等缺点,也限制了磷酸铁锂的应用。最近比亚迪搞出了一个改性磷酸铁锂材料,把能量密度提升了不少,还未透露具体的技术细节,不知道掺杂了什么材料在里面。就产品应用领域而言,电力储能市场应该是磷酸铁锂离子电池的一个重要市场,相对而言,这个市场对能量密度不是特别敏感,而对长寿命,低成本,高安全性电池的迫切需求,正是磷酸铁锂材料的优势所在。
日韩企业在近几年大力推动三元材料的应用,镍钴锰三元材料逐渐成为市场的主流,国内企业也采取跟随策略,逐步转向三元材料。三元材料的比容量较高,目前市场上的产品已经可以达到170~180mAh/g,从而可以将电池单体的能量密度提高到接近200Wh/kg,满足电动汽车的长续航里程要求。此外,通过改变三元材料的配比(x,y的值),还可以达到良好的倍率性能,从而满足PHEV和HEV车型对大倍率小容量锂离子电池的需求,这也正是三元材料大行其道的原因。从化学式可以看出,镍钴锰三元材料综合了钴酸锂(LiCoO2)和锰酸锂(LiMn2O4)的一些优点,同时因为掺杂了镍元素,可以提升能量密度和倍率性能。
镍钴铝三元材料,严格来说,其实算是一种改性的镍酸锂(LiNiO2)材料,在其中掺杂了一定比例的钴和铝元素(占比较少)。商业化应用方面主要是日本的松下公司在做,其他锂离子电池公司基本没有研究这个材料。之所以拿来对比,是因为鼎鼎大名的 Tesla,就是使用松下公司的18650镍钴铝三元电芯做电动汽车的动力电池系统,并且做到了接近500公里的续航里程,说明了这种正极材料,还是有其独特的价值。
以上仅仅是比较常见的锂离子电池正极材料,并不代表所有的技术路线。实际上,不管是高校和科研院所,还是企业,都在努力研究新型的锂离子电池正极材料,希望把能量密度和寿命等关键指标提升到更高的量级。当然,如果要在2020年达到250Wh/kg,甚至300Wh/kg的能量密度指标,现在商业化应用的正极材料都无法实现,那么正极材料就需要比较大的技术变革,如改变层状结构为尖晶石结构的固溶体类材料,以及有机化合物正极材料等,都是目前比较热门的研究方向。
2. 负极材料
相对而言,针对锂离子电池负极材料的研究,没有正极材料那么多,但是负极材料对锂离子电池性能的提高仍起着至关重要的作用,锂离子电池负极材料的选择应主要考虑以下几个条件:
1) 应为层状或隧道结构,以利于锂离子的脱嵌;
2) 在锂离子脱嵌时无结构上的变化,具有良好的充放电可逆性和循环寿命;
3) 锂离子在其中应尽可能多的嵌入和脱出,以使电极具有较高的可逆容量;
4) 氧化还原反应的电位要低,与正极材料配合,使电池具有较高的输出电压;
5) 首次不可逆放电比容量较小;
6) 与电解质溶剂相容性好;
7) 资源丰富、价格低廉;
8) 安全性好;
9) 环境友好。
锂离子电池负极材料的种类繁多,根据化学组成可以分为金属类负极材料(包括合金)、无机非金属类负极材料及金属氧化物类负极材料。
(1)金属类负极材料:这类材料多具有超高的嵌锂容量。最早研究的负极材料是金属锂。由于电池的安全问题和循环性能不佳,金属锂作为负极材料并未得到广泛应用。近年来,合金类负极材料得到了比较广泛的研究,如锡基合金,铝基合金、镁基合金、锑基合等,是一个新的方向。
(2)无机非金属类负极材料:用作锂离子电池负极的无机非金属材料主要是碳材料、硅材料及其它非金属的复合材料。
(3)过渡金属氧化物材料:这类材料一般具有结构稳定,循环寿命长等优点,如锂过渡氧化物(钛酸锂等)、锡基复合氧化物等。
就当前的市场而言,在大规模商业化应用方面,负极材料仍然以碳材料为主,石墨类和非石墨类碳材料都有应用。在汽车及电动工具领域,钛酸锂作为负极材料也有一定的应用,主要是具有非常优异的循环寿命、安全性和倍率性能,但是会降低电池的能量密度,因此不是市场主流。其他类型的负极材料,除了SONY在锡合金方面有产品推出,大多仍以科学研究和工程开发为主,市场化应用的比较少。
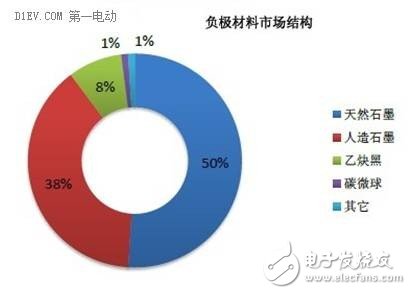
就未来的发展趋势而言,如果能有效解决循环性能,硅基材料将可能取代碳材料成为下一代锂离子电池的主要负极材料。锡合金,硅合金等合金类的负极材料,也是一个非常热门的方向,将走向产业化。此外,安全性和能量密度较高的铁氧化物,有可能取代钛酸锂(LTO),在一些长寿命和安全性要求较高的领域,得到广泛应用。
接下来的内容,我们将就锂离子电池与能量相关的两个关键指标:能量密度和充放电倍率,展开一些简短的论述。

能量密度,是单位体积或重量可以存储的能量多少,这个指标当然是越高越好,凡是浓缩的都是精华嘛。充放电倍率,是能量存储和释放的速度,最好是秒速,瞬间存满或释放,召之即来挥之即去。
当然,这些都是理想,实际上受制于各种各样的现实因素,我们既不可能获得无限的能量,也不可能实现能量的瞬间转移。如何不断的突破这些限制,达到更高的等级,就是需要我们去解决的难题。
五、 锂离子电池的能量密度
可以说,能量密度是制约当前锂离子电池发展的最大瓶颈。不管是手机,还是电动汽车,人们都期待电池的能量密度能够达到一个全新的量级,使得产品的续航时间或续航里程不再成为困扰产品的主要因素。
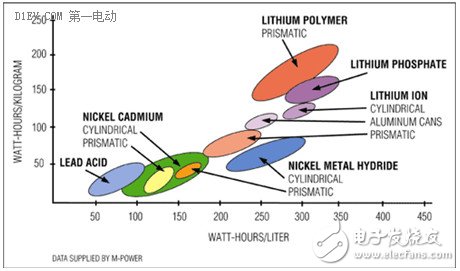
从铅酸电池、镍镉电池、镍氢电池、再到锂离子电池,能量密度一直在不断的提升。可是提升的速度相对于工业规模的发展速度而言,相对于人类对能量的需求程度而言,显得太慢了。甚至有人戏言,人类的进步都被卡在“电池”这儿了。当然,如果哪一天能够实现全球电力无线传输,到哪儿都能“无线”获得电能(像手机信号一样),那么人类也就不再需要电池了,社会发展自然也就不会卡在电池上面。
针对能量密度成为瓶颈的现状,全球各国都制订了相关的电池产业政策目标,期望引领电池行业在能量密度方面取得显著的突破。中、美、日等国政府或行业组织所制定的2020年目标,基本上都指向300Wh/kg这一数值,相当于在当前的基础上提升接近1倍。2030年的远期目标,则要达到500Wh/kg,甚至700Wh/kg,电池行业必须要有化学体系的重大突破,才有可能实现这一目标。
影响锂离子电池能量密度的因素有很多,就锂离子电池现有的化学体系和结构而言,具体都有哪些明显的限制呢?
前面我们分析过,充当电能载体的,其实就是电池当中的锂元素,其他物质都是“废物”,可是要获得稳定的、持续的、安全的电能载体,这些“废物”又是不可或缺的。举个例子,一块锂离子电池当中,锂元素的质量占比一般也就在1%多一点,其余99%的成分都是不承担能量存储功能的其他物质。爱迪生有句名言,成功是99%的汗水加上 1%的天赋,看来这个道理放之四海皆准啊,1%是红花,剩下的99%就是绿叶,少了哪个都不行。
那么要提高能量密度,我们首先想到的就是提高锂元素的比例,同时要让尽可能多的锂离子从正极跑出来,移动到负极,然后还得从负极原数返回正极(不能变少了),周而复始的搬运能量。
1. 提高正极活性物质的占比
提高正极活性物质占比,主要是为了提高锂元素的占比,在同一个电池化学体系中,锂元素的含量上去了(其他条件不变),能量密度也会有相应的提升。所以在一定的体积和重量限制下,我们希望正极活性物质多一些,再多一些。
2. 提高负极活性物质的占比
这个其实是为了配合正极活性物质的增加,需要更多的负极活性物质来容纳游过来的锂离子,存储能量。如果负极活性物质不够,多出来的锂离子会沉积在负极表面,而不是嵌入内部,出现不可逆的化学反应和电池容量衰减。
3. 提高正极材料的比容量(克容量)
正极活性物质的占比是有上限的,不能无限制提升。在正极活性物质总量一定的情况下,只有尽可能多的锂离子从正极脱嵌,参与化学反应,才能提升能量密度。所以我们希望可脱嵌的锂离子相对于正极活性物质的质量占比要高,也就是比容量指标要高。
这就是我们研究和选择不同的正极材料的原因,从钴酸锂到磷酸铁锂,再到三元材料,都是奔着这个目标去的。
前面已经分析过,钴酸锂可以达到137mAh/g,锰酸锂和磷酸铁锂的实际值都在120mAh/g左右,镍钴锰三元则可以达到180mAh/g。如果要再往上提升,就需要研究新的正极材料,并取得产业化进展。
4. 提高负极材料的比容量
相对而言,负极材料的比容量还不是锂离子电池能量密度的主要瓶颈,但是如果进一步提升负极的比容量,则意味着以质量更少的负极材料,就可以容纳更多的锂离子,从而达到提升能量密度的目标。
以石墨类碳材料做负极,理论比容量在372mAh/g,在此基础上研究的硬碳材料和纳米碳材料,则可以将比容量提高到600mAh/g以上。锡基和硅基负极材料,也可以将负极的比容量提升到一个很高的量级,这些都是当前研究的热点方向。
5. 减重瘦身
除了正负极的活性物质之外,电解液、隔离膜、粘结剂、导电剂、集流体、基体、壳体材料等,都是锂离子电池的“死重”,占整个电池重量的比例在40%左右。如果能够减轻这些材料的重量,同时不影响电池的性能,那么同样也可以提升锂离子电池的能量密度。
在这方面做文章,就需要针对电解液、隔离膜、粘结剂、基体和集流体、壳体材料、制造工艺等方面进行详细的研究和分析,从而找出合理的方案。各个方面都改善一些,就可以将电池的能量密度整体提升一个幅度。
从以上的分析可以看出,提升锂离子电池的能量密度是一个系统工程,要从改善制造工艺、提升现有材料性能、以及开发新材料和新化学体系这几个方面入手,寻找短期、中期和长期的解决方案。
六、 锂离子电池的充放电倍率
锂离子电池的充放电倍率,决定了我们可以以多快的速度,将一定的能量存储到电池里面,或者以多快的速度,将电池里面的能量释放出来。当然,这个存储和释放的过程是可控的,是安全的,不会显著影响电池的寿命和其他性能指标。
倍率指标,在电池作为电动工具,尤其是电动交通工具的能量载体时,显得尤为重要。设想一下,如果你开着一辆电动车去办事,半路发现快没电了,找个充电站充电,充了一个小时还没充满,估计要办的事情都耽误了。又或者你的电动汽车在爬一个陡坡,无论怎么踩油门(电门),车子却慢的像乌龟,使不上劲,自己恨不得下来推车。
显然,以上这些场景都是我们不希望看到的,但是却是当前锂离子电池的现状,充电耗时久,放电也不能太猛,否则电池就会很快衰老,甚至有可能发生安全问题。但是在许多的应用场合,我们都需要电池具有大倍率的充放电性能,所以我们又一次卡在了“电池”这儿。为了锂离子电池获得更好的发展,我们有必要搞清楚,都是哪些因素在限制电池的倍率性能。
锂离子电池的充放电倍率性能,与锂离子在正负极、电解液、以及他们之间界面处的迁移能力直接相关,一切影响锂离子迁移速度的因素(这些影响因子也可等效为电池的内阻),都会影响锂离子电池的充放电倍率性能。此外,电池内部的散热速率,也是影响倍率性能的一个重要因素,如果散热速率慢,大倍率充放电时所积累的热量无法传递出去,会严重影响锂离子电池的安全性和寿命。因此,研究和改善锂离子电池的充放电倍率性能,主要从提高锂离子迁移速度和电池内部的散热速率两个方面着手。
1. 提高正、负极的锂离子扩散能力
锂离子在正/负极活性物质内部的脱嵌和嵌入的速率,也就是锂离子从正/负极活性物质里面跑出来的速度,或者从正/负极表面进入活性物质内部找个位置“安家”的速度到底有多快,这是影响充放电倍率的一个重要因素。

举个例子,全球每年都有会很多的马拉松比赛,虽然大家基本同一时间出发,可是道路宽度有限,参与的却人很多(有时多达上万人),造成相互拥挤,加上参与人员的身体素质参差不齐,比赛的队伍最后会变成一个超长的战线。有人很快到达终点,有人晚到几个小时,有人跑到昏厥,半路就歇菜了。
锂离子在正/负极的扩散和移动,与马拉松比赛基本差不多,跑得慢的,跑得快的都有,加上各自选择的道路长短不一,严重制约了比赛结束的时间(所有人都跑完)。所以呢,我们不希望跑马拉松,最好大家都跑百米,距离足够短,所有人都可以快速达到终点,另外,跑道要足够的宽,不要相互拥挤,道路也不要曲折蜿蜒,直线是最好的,要降低比赛难度。如此一来,裁判一声令响,千军万马一起奔向终点,比赛快速结束,倍率性能优异。
在正极材料处,我们希望极片要足够的薄,也就是活性材料的厚度要小,这样等于缩短了赛跑的距离,所以希望尽可能的提高正极材料压实密度。在活性物质内部,要有足够的孔间隙,给锂离子留出比赛的通道,同时这些“跑道”分布要均匀,不要有的地方有,有的地方没有,这就要优化正极材料的结构,改变粒子之间的距离和结构,做到均匀分布。以上两点,其实是相互矛盾的,提高压实密度,虽然厚度变薄,但是粒子间隙会变小,跑道就会显得拥挤,反之,保持一定的粒子间隙,不利于把材料做薄。所以需要寻找一个平衡点,以达到最佳的锂离子迁移速率。
此外,不同材料的正极物质,对锂离子的扩散系数有显著影响。因此,选择锂离子扩散系数比较高的正极材料,也是改善倍率性能的重要方向。
负极材料的处理思路,与正极材料类似,也是主要从材料的结构、尺寸、厚度等方面着手,减小锂离子在负极材料中的浓度差,改善锂离子在负极材料中的扩散能力。以碳基负极材料为例,近年来针对纳米碳材料的研究(纳米管、纳米线、纳米球等),取代传统的负极层状结构,就可以显著的改善负极材料的比表面积、内部结构和扩散通道,从而大幅度提升负极材料的倍率性能。
2. 提高电解质的离子电导率
锂离子在正/负极材料里面玩的是赛跑,在电解质里面的比赛项目却是游泳。
游泳比赛,如何降低水(电解液)的阻力,就成为速度提升的关键。近年来,游泳运动员普遍穿着鲨鱼服,这种泳衣可以极大的降低水在人体表面形成的阻力,从而提高运动员的比赛成绩,并且成为非常有争议的话题。
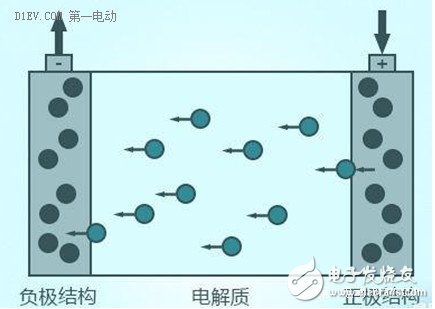
锂离子要在正、负极之间来回穿梭,就如同在电解质和电池壳体所构成的“游泳池”里面游泳,电解质的离子电导率如同水的阻力一样,对锂离子游泳的速度有非常大的影响。目前锂离子电池所采用的有机电解质,不管是液体电解质,还是固体电解质,其离子电导率都不是很高。电解质的电阻成为整个电池电阻的重要组成部分,对锂离子电池高倍率性能的影响不容忽视。
除了提高电解质的离子电导率之外,还需要着重关注电解质的化学稳定性和热稳定性。在大倍率充放电时,电池的电化学窗口变化范围非常宽,如果电解质的化学稳定性不好,容易在正极材料表面氧化分解,影响电解质的离子电导率。电解液的热稳定性则对锂离子电池的安全性和循环寿命有非常大的影响,因为电解质受热分解时会产生很多气体,一方面对电池安全构成隐患,另一方面有些气体对负极表面的SEI膜产生破坏作用,影响其循环性能。
因此,选择具有较高的锂离子传导能力、良好的化学稳定性和热稳定性、且与电极材料匹配的电解质是提高锂离子电池倍率性能的一个重要方向。
3. 降低电池的内阻
这里涉及到几种不同的物质和物质之间的界面,它们所形成的电阻值,但都会对离子/电子的传导产生影响。
一般在正极活性物质内部会添加导电剂,从而降低活性物质之间、活性物质与正极基体/集流体的接触电阻,改善正极材料的电导率(离子和电子电导率),提升倍率性能。不同材料不同形状的导电剂,都会对电池的内阻产生影响,进而影响其倍率性能。
正负极的集流体(极耳)是锂离子电池与外界进行电能传递的载体,集流体的电阻值对电池的倍率性能也有很大的影响。因此,通过改变集流体的材质、尺寸大小、引出方式、连接工艺等,都可以改善锂离子电池的倍率性能和循环寿命。
电解质与正负极材料的浸润程度,会影响电解质与电极界面处的接触电阻,从而影响电池的倍率性能。电解质的总量、粘度、杂质含量、正负极材料的孔隙等,都会改变电解质与电极的接触阻抗,是改善倍率性能的重要研究方向。
锂离子电池在第一次循环的过程中,随着锂离子嵌入负极,在负极会形成一层固态电解质(SEI)膜,SEI膜虽然具有良好的离子导电性,但是仍然会对锂离子的扩散有一定的阻碍作用,尤其是大倍率充放电的时候。随着循环次数的增加,SEI膜会不断脱落、剥离、沉积在负极表面,导致负极的内阻逐渐增加,成为影响循环倍率性能的因素。因此,控制SEI膜的变化,也能够改善锂离子电池长期循环过程中的倍率性能。
此外,隔离膜的吸液率和孔隙率也对锂离子的通过性有较大的影响,也会一定程度上影响锂离子电池的倍率性能(相对较小)。
七、 锂离子电池的循环寿命
电池用着用着,感觉不耐用,容量没有以前多了,这些都是循环寿命不断衰减的体现。
循环寿命的衰减,其实也就是电池当前的实际可用容量,相对于其出厂时的额定容量,不断下降的一种变化趋势。
对于理想的锂离子电池,在其循环周期内容量平衡不会发生改变,每次循环中的初始容量都应该是一定值,然而实际上情况却复杂得多。任何能够产生或消耗锂离子的副反应都可能导致电池容量平衡的改变,一旦电池的容量平衡状态发生改变,这种改变就是不可逆的,并且可以通过多次循环进行累积,对电池循环性能产生严重影响。
影响锂离子电池循环寿命的因素有很多,但其内在的根本原因,还是参与能量转移的锂离子数量在不断减少。需要注意的是,电池当中的锂元素总量并未减少,而是“活化”的锂离子少了,它们被禁锢在了其他地方或活动的通道被堵塞了,不能自由的参与循环充放电的过程。
那么,我们只要搞清楚这些本该参与氧化还原反应的锂离子,都跑哪儿去了,就能够搞清楚容量下降的机理,也就可以针对性的采取措施,延缓锂电池的容量下降趋势,提升锂电池的循环寿命。
1. 金属锂的沉积
通过前面的分析,我们知道锂离子电池当中是不应该存在锂的金属形态,锂元素要么是以金属氧化物、碳锂化合物的形态存在,要么是以离子的形态存在。
金属锂的沉积,一般发生在负极表面。由于一定的原因,锂离子在迁移到负极表面时,部分锂离子没有进入负极活性物质形成稳定的化合物,而是获得电子后沉积在负极表面成为金属锂,并且不再参与后续的循环过程,导致容量下降。
这种情况,一般有几种原因造成:充电超过截止电压;大倍率充电;负极材料不足。过充电或负极材料不足的时候,负极不能容纳从正极迁移过来的锂离子,导致金属锂的沉积发生。大倍率充电时,由于锂离子短时间内到达负极的数量过多,造成堵塞和沉积。
金属锂的沉积,不但会造成循环寿命的下降,严重时还会导致正负极短路,造成严重的安全问题。
要解决这个问题,就需要合理的正负极材料配比,同时严格限定锂电池的使用条件,避免超过使用极限的情况。当然,从倍率性能着手,也可以局部改善循环寿命。
2. 正极材料的分解
作为正极材料的含锂金属氧化物,虽然具有足够的稳定性,但是在长期的使用过程中,仍然会不断的分解,产生一些电化学惰性物质(如Co3O4,Mn2O3等)以及一些可燃性气体,破坏了电极间的容量平衡,造成容量的不可逆损失。
这种情况在过充电情况下尤为明显,有时甚至会发生剧烈的分解和气体释放,不但影响电池容量,还会造成严重的安全风险。
除了严格限定电池的充电截止电压之外,提高正极材料的化学稳定性和热稳定性,也是降低循环寿命下降速度的可行方法。
3. 电极表面的SEI膜
前面讲过,以碳材料为负极的锂离子电池,在初次循环过程中,电解液会在电极表面形成一层固态电解质(SEI)膜,不同的负极材料会有一定的差别,但SEI膜的成分主要由碳酸锂、烷基酯锂、氢氧化锂等组成,当然也有盐的分解产物,另外还有一些聚合物等。
SEI膜的形成过程会消耗电池中的锂离子,并且SEI膜并不是稳定不变的,会在循环过程中不断的破裂,露出来新的碳表面再与电解质反应形成新的SEI 膜,这样会不断造成锂离子和电解质的持续损耗,导致电池的容量下降。SEI膜有一定的厚度,虽然锂离子可以穿透,但是SEI膜会造成负极表面部分扩散孔道的堵塞,不利于锂离子在负极材料的扩散,这也会造成电池容量的下降。
4. 电解质的影响
在不断的循环过程中,电解质由于化学稳定性和热稳定性的局限,会不断发生分解和挥发,长期累积下来,导致电解质总量减少,不能充分的浸润正负极材料,充放电反应不完全,造成实际使用容量的下降。
电解质中含有活泼氢的物质和铁、钠、铝、镍等金属离子杂质。因为杂质的氧化电位一般低于锂离子电池的正极电位,易在正极表面氧化,氧化物又在负极还原,不断消耗正负极活性物质,引起自放电,即在非正常使用的情况下改变电池放电。电池寿命是以充放电循环次数而定的,含杂质的电解液直接影响电池循环次数。
电解质中还含有一定量的水,水会与电解质中的LiFP6发生化学反应,生产LiF和HF,HF进而又破坏SEI膜,生成更多的LiF,造成LiF沉积,不断的消耗活性的锂离子,造成电池循环寿命下降。
由以上分析可以看出,电解质对锂离子电池的循环寿命有非常重要的影响,选择合适的电解质,将能够明显的提升电池的循环寿命。
5. 隔离膜阻塞或损坏
隔离膜的作用是将电池正负极分开防止短路。在锂离子电池循环过程中,隔离膜逐渐干涸失效是电池早期性能衰退的一个重要原因。这主要是由于隔离膜本身的电化学稳定性和机械性能不足,以及对电解质对隔离膜的浸润性在反复充电过程中变差造成的。由于隔离膜的干涸,电池的欧姆内阻增大,导致充放电通道堵塞,充放电不完全,电池容量无法回复到初始状态,大大降低了电池的容量和使用寿命。
6. 正负极材料脱落
正负极的活性物质,是通过粘结剂固定在基体上面的,在长期使用过程中,由于粘结剂的失效以及电池受到机械振动等原因,正负极的活性物质不断脱落,进入电解质溶液,这导致能够参与电化学反应的活性物质不断减少,电池的循环寿命不断下降。
粘结剂的长期稳定性和电池良好的机械性能,将能够延缓电池循环寿命的下降速度。
7. 外部使用因素
锂离子电池有合理的使用条件和范围,如充放电截止电压,充放电倍率,工作温度范围,存储温度范围等。但是在实际使用当中,超出允许范围的滥用情况非常普遍,长期的不合理使用,会导致电池内部发生不可逆的化学反应,造成电池机理的破坏,加速电池的老化,造成循环寿命的迅速下降,严重时,还会造成安全事故。
八、 锂离子电池的安全性
锂离子电池的安全性问题,其内在原因是电池内部发生了热失控,热量不断的累积,造成电池内部温度持续上升,其外在的表现是燃烧、爆炸等剧烈的能量释放现象。
电池是能量的高密度载体,本质上就存在不安全因素,能量密度越高的物体,其能量剧烈释放时的影响就越大,安全问题也越突出。汽油、天然气、乙炔等高能量载体,也都存在同样的问题,每年发生的安全事故,数不胜数。
不同的电化学体系、不同的容量、工艺参数、使用环境、使用程度等,都对锂离子电池的安全性有较大的影响。
由于电池存储能量,在能量释放的过程中,当电池热量产生和累积速度大于散热速度时,电池内部温度就会持续升高。锂离子电池由高活性的正极材料和有机电解液组成,在受热条件下非常容易发生剧烈的化学副反应,这种反应将产生大量的热,甚至导致的“热失控”,是引发电池发生危险事故的主要原因。

锂离子电池内部的热失控,说明电池内部的一些化学反应已经不是我们此前所期待的“可控”和“有序”,而是呈现出不可控和无序的状态,导致能量的快速剧烈释放。
那么,我们来看看,都有哪些化学反应,会伴随大量的热产生,进而导致热失控。
1. SEI膜分解,电解液放热副反应
固态电解质膜实在锂离子电池初次循环过程中形成,我们既不希望SEI膜太厚,也不希望它完全不存在。合理的SEI膜存在,能够保护负极活性物质,不跟电解液发生反应。
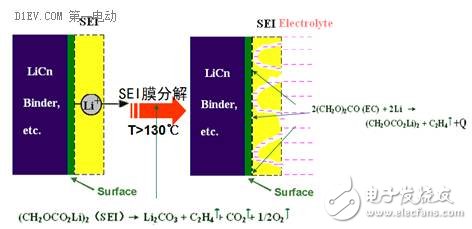
可是当电池内部温度达到130℃左右时,SEI膜就会分解,导致负极完全裸露,电解液在电极表面大量分解放热,导致电池内部温度迅速升高。
这是锂电池内部第一个放热副反应,也是一连串热失控问题的起点。
2. 电解质的热分解
由于电解质在负极的放热副反应,电池内部温度不断升高,进而导致电解质内的LiPF6和溶剂进一步发生热分解。

这个副反应发生的温度范围大致在130℃~250℃之间,同样伴随着大量的热产生,进一步推高电池内部的温度。
3. 正极材料的热分解
随着电池内部温度的进一步上升,正极的活性物质发生分解,这一反应一般发生在180℃~500℃之间,并伴随大量的热和氧气产生。
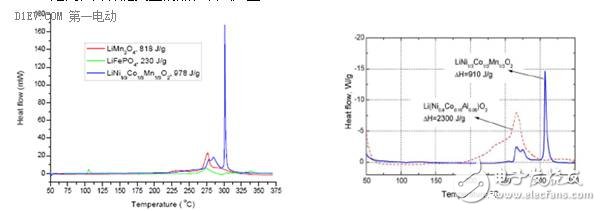
不同的正极材料,其活性物质分解所产生的热量是不同的,所释放的氧气含量也有所不同。磷酸铁锂正极材料由于分解时产生的热量较少,因而在所有的正极材料中,热稳定性最为突出。镍钴锰三元材料分解时则会产生较多的热量,同时伴有大量的氧气释放,容易产生燃烧或爆炸,因此安全性相对较低。
4. 粘结剂与负极高活性物质的反应
负极活性物质LixC6与PVDF粘结剂的反应温度约从240℃开始,峰值出现在290℃,反应放热可达1500J/g。
由以上分析可以看出,锂离子电池的热失控,并不是瞬间完成的,而是一个渐进的过程。这个过程,一般由过充、大倍率充放电、内短路、外短路、振动、碰撞、跌落、冲击等原因,导致电池内部短时间内产生大量的热,并不断的累积,推动电池的温度不断上升。

一旦温度上升到内部连锁反应的门槛温度(约130℃),锂离子电池内部将会自发的产生一系列的放热副反应,并进一步加剧电池内部的热量累积和温度上升趋势,这一过程还会析出大量的可燃性气体。当温度上升到内部溶剂和可燃性气体的闪点、燃点时,将会导致燃烧和爆炸等安全事故。
刚出厂的锂离子电池通过安全测试认证,并不代表锂离子电池在生命周期中的安全性。根据我们前面的分析,在长期的使用过程中,会发生负极表面的锂金属沉积,电解液的分解和挥发,正负极活性物质的脱落,电池内部结构变形,材料中混入金属杂质,以及其他很多非预期的变化,这些都会导致电池发生内短路,进而产生大量的热量。再加上外部的各种滥用情况,如过充、挤压、金属穿刺、碰撞、跌落、冲击等,也会导致电池在短时间内产生大量的热量,成为热失控的诱因。
在锂离子电池的使用过程中,没有绝对的安全性,只有相对的安全性。我们要尽量避免滥用的情况出现,降低危害事件发生的概率,同时也要从正负极材料、电解液、隔离膜等主要成分入手,选择化学稳定性和热稳定性优良的材料,具有良好的阻燃特性,在出现内外部热失控的诱因时,降低内部副反应的发热量,或者具有很高的燃点温度,避免热失控现象的发生。在电池结构和壳体设计上面,要充分考虑结构稳定性,达到足够的机械强度,能够耐受外部的应力,确保内部不发生明显的变形。此外,散热性能也是需要着重考虑的,如果热量能够及时的散发出去,内部的温度就不会持续上升,热失控也就不会发生。
锂离子电池的安全性设计,是系统论,单纯的以正极材料分解发热来衡量锂离子电池安全性并不全面。从系统的角度讲,磷酸铁锂电池不见得一定比三元材料的电池更安全,因为最终影响热失控的因素很多,正极材料分解所产生的热量仅仅是其中的一个因素。
九、 总结与展望
大约在135亿年前,经过所谓的“大爆炸”之后,宇宙中的物质、能量、时间和空间形成了现在的样子。宇宙的这些基本特征,就成了“物理学”。
在这之后过了大约30万年,物质和能量开始形成复杂的结构,称为“原子”,再进一步构成“分子”。至于这些原子和分子的故事以及它们如何互动,就成了“化学”。
所有关于电池的原理,都得通过物理学和化学的理论来阐述,并受到客观规律的制约,脱离了这个范畴,我们既不可能发明电池,也不可能正确使用电池。
人类对电池的研究和使用已经有近200年的历史,在大规模的商业化应用方面,铅酸电池、碱性电池、锌锰电池、镍镉电池、镍氢电池、锂离子电池早已渗透到人类社会的方方面面,在支持工业化社会的正常运作方面,起着无可替代的作用。
人类对能量进行移动存储的追求,随着经济规模的扩大,呈现快速增长的趋势,这也在客观上推动了电池技术的发展和变革,要做到更快、更强、更长寿、更安全、更环保,同时单位价格还要更便宜。
自SONY在90年代将锂离子电池商业化以来,经过20多年的发展,现有的电化学体系已经逐步接近了瓶颈,未来将逐步进入“后锂电池”时代。市场的强劲需求,必将推动和催生新的材料、新的化学体系、新的工艺在电池领域的应用,从而实现大的突破。
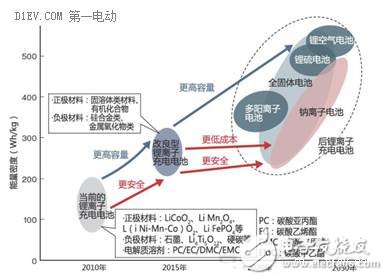
在电池产业,新的研究方向层出不穷,而比较有希望商业化的方向,比如全固态锂离子电池、钠离子电池、锂-硫电池、锂空气电池等。“后锂电池”时代,将会是百花齐放、百家争鸣的局面,市场需求的多样性,技术路线的多样性,再结合原料供应的地缘因素,将给我们带来更多的选择和更好的体验。











评论